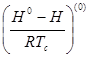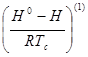Прогнозирование энтальпии образования при нормальных и повышенных давлениях
В уравнении (1.2):
- ацентрический фактор;
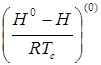 - поправка к энтальпии на давление, характеризующая поведение простого вещества;
- поправка к энтальпии на давление, характеризующая поведение простого вещества;
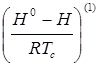 - функция отклонения в поведении рассматриваемого вещества от поведения простого вещества;
- функция отклонения в поведении рассматриваемого вещества от поведения простого вещества;
![]() - идеально-газовая энтальпия вещества при рассматриваемой температуре; в случае расчета энтальпий образования органических соединений это
- идеально-газовая энтальпия вещества при рассматриваемой температуре; в случае расчета энтальпий образования органических соединений это ![]() ;
;
![]() - искомая энтальпия, в нашем случае это
- искомая энтальпия, в нашем случае это ![]() ;
;
![]() - газовая постоянная, равная 8,31441 Дж/(моль×К) или 1,98725 кал/(моль×К);
- газовая постоянная, равная 8,31441 Дж/(моль×К) или 1,98725 кал/(моль×К); ![]() - критическая температура вещества, К.
- критическая температура вещества, К.
Таблицы Ли-Кеслера составлены на основе достаточно универсального уравнения состояния вещества (уравнение Бенедикта-Уэбба-Рубина) с соблюдением общепринятых принципов, т.е. между любыми соседними значениями в столбцах или строках таблицы корректной является линейная интерполяция. В таблицах область над линией излома принадлежит жидкому состоянию вещества.
Расчет ![]() иллюстрируется примером 1.3.
иллюстрируется примером 1.3.
Пример 1.3
Рассчитать ![]() циклогексана при давлении, изменяющемся от 0,4 до 120,6 атм, и при температурах 304,37, 415,05 и 581,07 К. Дать графическую зависимость изотерм и выполнить их анализ. Указать фазовые состояния циклогексана при рассматриваемых параметрах. Критические температура, давление и ацентрический фактор циклогексана равны: 553,4 К, 40,2 атм и 0,213.
циклогексана при давлении, изменяющемся от 0,4 до 120,6 атм, и при температурах 304,37, 415,05 и 581,07 К. Дать графическую зависимость изотерм и выполнить их анализ. Указать фазовые состояния циклогексана при рассматриваемых параметрах. Критические температура, давление и ацентрический фактор циклогексана равны: 553,4 К, 40,2 атм и 0,213.
Решение
1. Рассчитываются ![]() при интересующих температурах. Поскольку последние попадают в интервал, рассмотренный в примере 1.2, и на каждом из участков возможна линейная интерполяция теплоемкостей циклогексана и простых веществ, его образующих, то корректной будет и линейная интерполяция вычисленных в примере 1.2 значений
при интересующих температурах. Поскольку последние попадают в интервал, рассмотренный в примере 1.2, и на каждом из участков возможна линейная интерполяция теплоемкостей циклогексана и простых веществ, его образующих, то корректной будет и линейная интерполяция вычисленных в примере 1.2 значений ![]() . Таким образом, имеем
. Таким образом, имеем
![]() = (–134,32– (– 123,34))/100 4,37+( – 123,34) = –123,82 кДж/моль.
= (–134,32– (– 123,34))/100 4,37+( – 123,34) = –123,82 кДж/моль.
Аналогично ![]() = (–142,81+134,32)/100 15,05–134,32 = –135,59 кДж/моль;
= (–142,81+134,32)/100 15,05–134,32 = –135,59 кДж/моль;
![]() = –147,87 кДж/моль.
= –147,87 кДж/моль.
2. Рассчитываются приведенные температуры:
![]() = 304,37/553,4 =0,55;
= 304,37/553,4 =0,55; ![]() = 415,05/553,4 =0,75;
= 415,05/553,4 =0,75; ![]() = 581,07/553,4 = 1,05.
= 581,07/553,4 = 1,05.
3. При полученных приведенных температурах и значениях приведенных давлений c помощью таблиц Ли-Кеслера и рассчитанных величин ![]() вычисляются значения
вычисляются значения ![]() .
.
Для ![]() и P = 2,01 атм имеем
и P = 2,01 атм имеем
![]() = –123,82–(5,312+0,213×8,211)×8,31441×553,4/1000 = –156,31 кДж/моль.
= –123,82–(5,312+0,213×8,211)×8,31441×553,4/1000 = –156,31 кДж/моль.
Фрагмент результатов расчета приведен в табл. 1.15 и 1.16, где жирным шрифтом выделены сведения, относящиеся к жидкому состоянию циклогексана.
Дело в том, что различие в энергиях конформеров, обусловленных взаимной ориентацией атомов и групп соседних заместителей в ароматическом ядре, оказывается достаточным, чтобы учесть этот фактор при формировании аддитивной схемы. Суть вопроса становится понятной при конформационном анализе соединений с относительно несложным строением молекул, например метилбензолов (МБ), проведенного с помощью программы Gaussian 03W методом B3LYP/6-311G++2d,2p. Указанный метод дает для о-ксилола два сосуществующих конформера (“А” и “В”, рис. 1.2)
Один из них (“А”) характеризуется взаимным транс-расположением атомов водорода метильных групп, лежащих в плоскости ароматического ядра, в другом (“В”) атомы водорода метильных групп имеют шахматную ориентацию по отношению друг к другу. Различие в энергиях этих конформеров по результатам расчета составляет для ![]() 5,2 кДж/моль. Очевидно, что при таком соотношении в энергиях о-ксилол представлен при 298 К преимущественно конформером “А”, и эффект взаимодействия заместителей (орто-эффект типа “метил-метил” или C1-C1(транс-“Н-Н”)) для
5,2 кДж/моль. Очевидно, что при таком соотношении в энергиях о-ксилол представлен при 298 К преимущественно конформером “А”, и эффект взаимодействия заместителей (орто-эффект типа “метил-метил” или C1-C1(транс-“Н-Н”)) для ![]() составляет 2,76 кДж/моль. Но очевидно также и то, что указанное расположение метильных групп возможно только для двух соседних заместителей, третий и последующие заместители уже не могут иметь транс-ориентации атомов водорода. Выполненный нами конформационный анализ показал, что для 1,2,3-триМБ энергетически наиболее выгодным конформером является “С” (рис. 1.3), который для двух соседних групп имеет транс-ориентацию атомов водорода, лежащих в плоскости ароматического ядра, а третья метильная группа подстроена к соседней “шахматно”. Таким образом, суммарный эффект взаимодействия замести телей, дестабилизирующий молекулу 1,2,3-триМБ, составляет для
составляет 2,76 кДж/моль. Но очевидно также и то, что указанное расположение метильных групп возможно только для двух соседних заместителей, третий и последующие заместители уже не могут иметь транс-ориентации атомов водорода. Выполненный нами конформационный анализ показал, что для 1,2,3-триМБ энергетически наиболее выгодным конформером является “С” (рис. 1.3), который для двух соседних групп имеет транс-ориентацию атомов водорода, лежащих в плоскости ароматического ядра, а третья метильная группа подстроена к соседней “шахматно”. Таким образом, суммарный эффект взаимодействия замести телей, дестабилизирующий молекулу 1,2,3-триМБ, составляет для ![]() 7,63 кДж/моль (2,76+4,87), а величину 2,11 кДж/моль, равную 7,63-2·2,76 кДж/моль, можно было бы воспринять в рамках схемы Кокса-Пилчера [2] как дополнительный “тройной” эффект (сверх удвоенного орто-эффекта). Однако указанная ситуация в группе метилбензолов реализуется только в случае 1,2,3,5-тетраМБ, т.е. носит довольно частный характер. Расчет показывает, что для 1,2,3,4-тетраМБ и пента-МБ две группы транс-ориентированы, а остальные шахматно подстроены. В случае гекса-МБ все заместители имеют шахматную ориентацию.
7,63 кДж/моль (2,76+4,87), а величину 2,11 кДж/моль, равную 7,63-2·2,76 кДж/моль, можно было бы воспринять в рамках схемы Кокса-Пилчера [2] как дополнительный “тройной” эффект (сверх удвоенного орто-эффекта). Однако указанная ситуация в группе метилбензолов реализуется только в случае 1,2,3,5-тетраМБ, т.е. носит довольно частный характер. Расчет показывает, что для 1,2,3,4-тетраМБ и пента-МБ две группы транс-ориентированы, а остальные шахматно подстроены. В случае гекса-МБ все заместители имеют шахматную ориентацию.
4. Зависимость ![]() от давления при избранных температурах приведена на рис. 1.5. Характер полученных графических зависимостей различен для изотерм, принадлежащих жидкому и газообразному состояниям вещества. Энтальпия образования жидкости в меньшей степени зависит от давления, от чем газа, что очевидно. Характер изменения энтальпии в закритической области сложен, особенно вблизи критической точки. Для докритической изотермы резкое изменение энтальпии сопряжено с изменением фазового состояния вещества.
от давления при избранных температурах приведена на рис. 1.5. Характер полученных графических зависимостей различен для изотерм, принадлежащих жидкому и газообразному состояниям вещества. Энтальпия образования жидкости в меньшей степени зависит от давления, от чем газа, что очевидно. Характер изменения энтальпии в закритической области сложен, особенно вблизи критической точки. Для докритической изотермы резкое изменение энтальпии сопряжено с изменением фазового состояния вещества.
Таблица 1.15
|
|
при приведенном давлении, |
при приведенном давлении, | ||||||||
|
0,010 |
0,050 |
0,100 |
0,200 |
0,400 |
0,010 |
0,050 |
0,100 |
0,200 |
0,400 | |
|
0,55 |
0,032 |
5,312 |
5,309 |
5,303 |
5,29 |
0,080 |
8,211 |
8,212 |
8,215 |
8,221 |
|
0,75 |
0,017 |
0,088 |
0,183 |
4,687 |
4,679 |
0,027 |
0,142 |
0,306 |
5,796 |
5,802 |
|
1,05 |
0,009 |
0,046 |
0,094 |
0,192 |
0,407 |
0,007 |
0,037 |
0,075 |
0,153 |
0,318 |