Активация алкенов и алкинов

Более характерными для π-комплексов II типа являются реакции, связанные с общим разрыхлением всей молекулы из-за переноса электронов на олефин. К таким реакциям следует отнести реакции циклообразования, внедрения по связи металл-металл, окислительного присоединения или замещения по связи =С-Х (где X = H, Cl, F).
Например:

Или
(CO)4Co-Co(CO)4 + CF2=CF2 → (CO)4Co- CF2CF2-Co(CO)4
Иногда активация олефина в π-комплексах II типа настолько лабилизирует связи в π-лиганде, что становится возможным разрыв связей С-Н при двойной связи и в соседней с двойной связью метильной группе, приводящий к продуктам окислительного присоединения:
Os3(CO)12 + C2H4 → H2Os3(C=CH2)(CO)9 + 3CO
3. ПУТИ АКТИВАЦИИ АЛКИНОВ
В ацетиленовых комплексах I типа (Ag(I), Cu(I), Hg(II), Pt(II), Pd(II), Ru(III) и др.) повышение электрофильности тройной связи приводит к облегчению взаимодействия с нуклеофильной частицей из раствора (транс-присоединение) или нуклеофилом, координированным металлом (цис-внедрение):

Основные реакции π-комплексов I типа довольно удачно промоделированы на комплексах Pt(II):

Образующийся катионный π-комплекс способен превращаться по нескольким направлениям:
 В π-комплексах II типа в первую очередь сильно разрыхляется тройная связь углерод-углерод и связь C-X при тройной связи. Так, активация связи С-Н в π-комплексах Ni(0), Pt(0), Os(0) или Rh(I) приводит к окислительному присоединению с образованием этинилгидридного комплекса металла:
В π-комплексах II типа в первую очередь сильно разрыхляется тройная связь углерод-углерод и связь C-X при тройной связи. Так, активация связи С-Н в π-комплексах Ni(0), Pt(0), Os(0) или Rh(I) приводит к окислительному присоединению с образованием этинилгидридного комплекса металла:

![]()
Вторая характерная реакция для π-комплексов II типа – это реакция циклообразования, причем в состав получающегося металлоцикла входят уже две молекулы алкина:

Металлоциклопентадиены из алкинов получены в реакциях комплексов Pt(0), Pd(0), Co(I), Fe(0), Rh(I), Ir(I) и Ti(II).
Активация полярных молекул
Полярные молекулы НХ, где Х – ОН, OR, Hal, CN, NH2, NR2, NHR, SR и др. активируются по механизму, близкому к механизму активации апротонными кислотами. Образование донорно-акцепторной связи между донорным атомом полярной молекулы и комплексом переходного металла, имеющим вакантные орбитали, приводит к ослаблению связи Н – Х. Ослабление связи H-X при координации этих молекул подтверждается, как правило, данными ИК-спектров координированных молекул. При этом в образующемся комплексе происходит смещение σ-пары электронов донорных атомов O, N или S к иону металла, обладающему акцепторными свойствами. Молекула лиганда поляризуется, что приводит к ее ионизации и облегчает диссоциацию (в полярных растворителях):

Смещение электронов и ослабление связи Х-Н при координации подтверждается данными ИК-спектров координированных молекул. Например, координация RNH2 в комплексах с PtCl2 приводит к понижению νN-H (на 80-100 см-1).
В результате повышается способность связи Н-Х к гетеролитической диссоциации с передачей протона на другой субстрат или его окислительному присоединению к переходному металлу (в зависимости от степени окисления металла и состояния его внутренней координационной сферы).
HX + MLn —→ H--X→MLn-1 + L
Даже такие слабые кислоты, как молекула аммиака или аминов, легко депротонируются в водных или неводных средах в координационной сфере переходных металлов:
TiCl4 + 6NH3 → TiCl(NH2)3 + 3 NH4Cl
Или
Pt(NH3)X5- + H2O → Pt(NH3)X52- + H3O+
В результате в комплексе металла появляется фрагмент молекулы HX (например, NH2), реакционная способность которого, конечно, ниже, чем свободного иона NH2-, но концентрация которого на много порядков выше, чем в отсутствие комплексообразователя.
Константа диссоциации ацетонитрила HCN, например, составляет 10-10. Образование комплексов с металлами позволяет существенно повысить концентрацию группы M-CN.
Так, при взаимодействии HCN с полиядерными комплексами меди(I)
CumCln(n-m)- + HCN → ClnCum-1(CuCN) + HCl
концентрация CuCN в растворе может достигать 15% вес. Координированный анион CN может далее участвовать в различных реакциях:
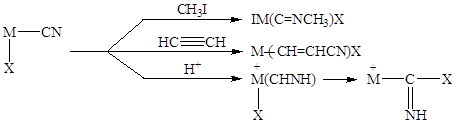
Для катализа особенно важны две последние реакции. Последняя реакция приводит к образованию изосинильной кислоты, способной внедряться по связи M-X.
Рекомендуемая литература
1. Г. Хенрици-Оливэ, С. Оливэ. Химия каталитического гидрирования СО. Москва, Мир, 1987 г.
2. Ф. Басоло, Р. Джонсон. Химия координационных соединений. Москва, Мир, 1966.
3. Под ред. Г. Цейсса. Химия металлоорганических соединений. Москва, Мир, 1964.
4. Э. Фишер, Г. Вернер. π-Комплексы металлов. Москва, Мир, 1968.
