Адсорбция и адсорбционные равновесия
Адсорбция - процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемом фазы.
Адсорбция может наблюдаться в многокомпонентных системах и при перераспределении в поверхностный слой уходит тот компонент, который сильнее понижает поверхностное натяжение. В однокомпонентной системе при формировании поверхностного слоя происходит изменение его структуры - уплотнение, которое называется автоадсорбцией.
В общем случае адсорбция может происходить не только благодаря стремлению поверхностной энергии к уменьшению, но и за счет химической реакции компонентов с поверхностью вещества. В этом случае поверхностная энергия может даже увеличиваться на фоне снижения энергии всей системы.
Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а вещество, которое перераспределяется – адсорбатом.
Обратный процесс перехода вещества с поверхности в объем фазы - десорбция.
В зависимости от агрегатного состояния фаз различают адсорбцию газа на твердых адсорбентах, твердое тело – жидкость, жидкость - жидкость, жидкость - газ. Для количественного описания адсорбции применяют две величины: первая измеряется числом молей или граммами, приходящимися на единицу поверхности или массы адсорбента:
А = m1/m2 - абсолютная адсорбция, А = ni/S.
Величина, определяемая избытком вещества в поверхностном слое, также отнесенным к единице площади поверхности или массы адсорбента, называется Гиббсовской или относительной адсорбцией (Г).

Адсорбция зависит от концентрации компонентов и температуры.
А = f(c,T)- жидкость;
А = f(P,T)- газ
Различают следующие виды зависимостей:
|
1. Изотерма (рис. 8) |
2. Изобара |
3. Изостера |
|
А=fT(c) |
А=fP(T) |
c=fA(T) |
|
A=fT(P) |
A=fC(T) |
P=fA(T) |
Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции. Адсорбционное уравнение Гиббса
Считаем Vповерхности раздела = 0.
dU = TdS +s dS+ ![]()
Проинтегрировав, получим: U = TS + sS+ ![]()
Полный дифференциал от этого уравнения:
dU = TdS + SdT + sdS + ![]() + Sds +
+ Sds + ![]() .
.
Подставляя значение dU из (6) в (7) и сократив одинаковые члены правой и левой части, получим:
SdT + Sds + ![]() = 0.
= 0.
Предположим, что T = const: ![]()
Разделив правую и левую часть на поверхность S, получим фундаментальное адсорбционное уравнение Гиббса:
![]() ;
; ![]() ;
;
![]() .
.
Определение зависимости поверхностного натяжения от адсорбции одного компонента, при постоянстве химических потенциалов других компонентов.
![]() .
.
Известно, что ![]() ,
, ![]() , (где
, (где ![]() ,
, ![]() - равновесный и стандартный химический потенциал компонента i; ln ai- логарифм активности i –го компонента). Тогда уравнение Гиббса будет выглядеть так
- равновесный и стандартный химический потенциал компонента i; ln ai- логарифм активности i –го компонента). Тогда уравнение Гиббса будет выглядеть так
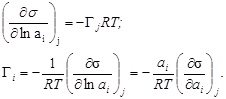
Активность связана с концентрацией: с = ×а. Предположим, что = 1 (при с ® 0). Тогда
 - для жидкости и газа
- для жидкости и газа

Обычно уравнение Гиббса применяют для растворов. Растворителем может быть не только индивидуальное вещество, но и смесь. В разбавленных растворах гиббсовская адсорбция очень мала, а его химический потенциал меняется очень мало с изменением концентрации растворенного вещества, т.е. dm= 0. Поэтому для разбавленного раствора фундаментальное уравнение Гиббса выглядит так:
![]()
Из этих уравнений следует, что зная зависимость ![]() = f(С) (где С - концентрация растворенного вещества), можно рассчитать изотерму адсорбции, пользуясь адсорбционным уравнением Гиббса. Схема графического расчета показана на рис. 2.2.2.1: Тангенс угла наклона соответствует значениям производных
= f(С) (где С - концентрация растворенного вещества), можно рассчитать изотерму адсорбции, пользуясь адсорбционным уравнением Гиббса. Схема графического расчета показана на рис. 2.2.2.1: Тангенс угла наклона соответствует значениям производных ![]() в этих точках.
в этих точках.
Зная эти производныеуравнения Гиббса, можно рассчитатьзначение Г, что позволяет построить зависимость Г = f(С). Уравнение Гиббса показывает, что единица измерения гиббсовской адсорбции не зависит от единицы измерений концентрации, а зависит от размерности величины R. Так как величина Rотнесена к молю вещества, а s-к единице площади, то Г = [моль/ единица площади]. Если sвыразить в [Дж/м2], то Rнужно подставлять: R= 8,314 Дж/моль×К.
Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. ПАВ. Эффект Ребиндера. Правило Дюкло-Траубе
В уравнении Гиббса влияние природы вещества на адсорбцию отражается производной![]() . Эта производная определяет и знак гиббсовской адсорбции, и может служить характеристикой вещества при адсорбции. Чтобы исключить влияние концентрации на производную берут ее предельные значения, т.е. при стремлении концентрации к нулю. Эту величину Ребиндер назвал поверхностной активностью.
. Эта производная определяет и знак гиббсовской адсорбции, и может служить характеристикой вещества при адсорбции. Чтобы исключить влияние концентрации на производную берут ее предельные значения, т.е. при стремлении концентрации к нулю. Эту величину Ребиндер назвал поверхностной активностью.
![]() ;
;
g = [Дж×м/моль] = [Н×м2/моль]; [эрг см/моль] = [Гиббс].
Уравнение показывает, что чем сильнее снижается ![]() = f(c) с увеличением концентрации, тем больше поверхностная активность этого вещества.
= f(c) с увеличением концентрации, тем больше поверхностная активность этого вещества.
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции.
Поверхностную активность можно представить как отрицательный тангенс угла наклона к касательной, проведенной к кривой Г = f(C) в точке пересечения с осью ординат. Поверхностная активность может быть положительной и отрицательной. Значение и знак ее зависят от природы растворенного вещества и растворителя.
