Молекулярно кинетическая теория
Современные экспериментальные методы физики (рентгеноструктурный анализ, наблюдения с помощью электронного микроскопа и др.) позволили наблюдать микроструктуру веществ.
2.Размеры молекул
Число граммов вещества, равное молекулярному весу этого вещества, называется грамм-молекулой или молем. Например, 2 г водорода составляет грамм-молекулу водорода; 32 г кислорода составляют грамм-молекулу кислорода. Масса одного моля вещества называется молярной массой этого вещества. Обозначается через m. Для водорода![]() ; для кислорода
; для кислорода ![]() ; для азота
; для азота![]() и т.д.
и т.д.
Число молекул, содержащихся в одном моле разных веществ одинаково и называется числом Авогадро (NA).
![]()
Число Авогадро чрезвычайно велико. Чтобы почувствовать его колоссальность, представьте себе, что в Черное море высыпали число булавочных головок (диаметр каждой около 1 мм), равное числу Авогадро. При этом оказалось бы, что в Черном море уже не остается места для воды: оно не только до краев, но и большим избытком оказалось бы заполненным этими булавочными головками. Авогадровым числом булавочных головок можно было бы засыпать площадь, равную, например, территории Франции, слоем толщиной около 1 км. И такое огромное число отдельных молекул содержится всего лишь в 18 г воды; в 2 г водорода и т.д.
Установлено, что в 1 см3 любого газа при нормальных условиях (т.е. при 00С и давлении 760 мм. рт. ст.) содержится 2,71019 молекул.
Если взять число кирпичей, равное этому числу, то, будучи плотно уложенными эти кирпичи покрыли бы поверхность всей суши Земного шара слоем высотой 120 м. Кинетическая теория газов позволяет вычислить лишь длину свободного пробега молекулы газа (т.е. среднее расстояние, которое проходит молекула от столкновения до столкновения с другими молекулами) и диаметр молекулы.
Приводим некоторые результаты этих вычислений.
|
Вещество |
Длина свободного пробега При 760 мм.рт.ст. |
Диаметр молекулы |
|
Водород Н2 |
1,12310-5 см |
2,310-8 см |
|
Кислород О2 |
0,64710-5 см |
2,910-8 см |
|
Азот N2 |
0,59910-5 см |
3,110-8 см |
Диаметры отдельных молекул - величины малые. При увеличении в миллион раз молекулы были бы величиной с точку типографского шрифта этой книжки. Обозначим через m - массу газа (любого вещества). Тогда отношение ![]() дает число молей газа.
дает число молей газа.
Число молекул газа n можно выразить: ![]() . (1) Число молекул в единице объема n0 будет равно:
. (1) Число молекул в единице объема n0 будет равно: ![]() , (2) где: V - объем газа.
, (2) где: V - объем газа.
Массу одной молекулы m0 можно определить по формуле:
 . (3)
. (3)
Относительной массой молекулы mотн называется величина, равная отношению абсолютной массы молекулы m0 к 1/12 массы атома углерода moc.
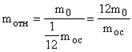 , (4) moc = 210-26 кг.
, (4) moc = 210-26 кг.
3.Микро- и макропараметры системы
Рассмотрим систему, состоящую из очень большого числа молекул n. Например, такой системой может быть газ.
В данный момент времени каждая молекула газа имеет свою энергию, скорость, направление движения, определенную массу и размеры. Величины, которые определяют поведение одной частицы в системе, носят название микропараметров. Микропараметры одной частицы могут меняться без внешних воздействий на систему. Например, скорости молекул газа могут непрерывно изменяться за счет столкновений между ними.
Величины, которые изменяются за счет внешних воздействий на систему, называются макропараметрами. К ним относятся: объем V, давление Р, температура Т.
Объем V - это область пространства, занимаемая телом. В Си измеряется в м3. 1 л = 10-3 м3.
Давление Р - скалярная физическая величина, характеризующая распределение силы по поверхности и равная проекции силы на направление нормали к площадке, на которую сила действует, и отнесенная к единице этой площади. При равномерном распределении силы F по плоской поверхности площадью S давление равно ![]() , где Fn - проекция силы F на нормаль к площади S. В Си единица давления - Паскаль = Па =
, где Fn - проекция силы F на нормаль к площади S. В Си единица давления - Паскаль = Па = ![]() . Внесистемная единица - мм.рт.ст. Нормальное давление равно одной физической атмосфере. 1 физическая атмосфера = 1 атм = 760 мм.рт.ст, 1 техническая атмосфера = 1 ат = 736 мм.рт.ст. 1 мм.рт.ст. = 133Па
. Внесистемная единица - мм.рт.ст. Нормальное давление равно одной физической атмосфере. 1 физическая атмосфера = 1 атм = 760 мм.рт.ст, 1 техническая атмосфера = 1 ат = 736 мм.рт.ст. 1 мм.рт.ст. = 133Па
Температура Т - параметр состояния, характеризующий степень нагретости тела и связанный с понятием теплового равновесия. Два тела, изолированные от окружающих тел, но имеющие возможность обмениваться энергией друг с другом, находятся в тепловом равновесии, если их термодинамические состояния не изменяются со временем. Телам, находящимся в тепловом равновесии друг с другом, приписывается одна и та же температура. Различают термодинамическую (абсолютную) температуру ТК и температуру Цельсия t0C. Связь между ними: ![]() . Абсолютную температуру в Си измеряют в градусах по шкале Кельвина.
. Абсолютную температуру в Си измеряют в градусах по шкале Кельвина.
Если два тела находятся в тепловом равновесии, то средние значения кинетической энергии поступательного движения ![]() частиц этих тел будут одинаковы.
частиц этих тел будут одинаковы.
Известно, что ![]() = 3/2 kT (для одной частицы) (5), где k - постоянная Больцмана;
= 3/2 kT (для одной частицы) (5), где k - постоянная Больцмана; ![]() . Из формулы (5) следует:
. Из формулы (5) следует: ![]() . (6)
. (6)
Таким образом, термодинамическая температура с молекулярно-кинетической точки зрения - физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Обратите внимание:
1) из (6) следует, что при ![]() = 0 и Т = 0;
= 0 и Т = 0;
2) температура, при которой прекращается хаотическое движение частиц тела, называется абсолютным нулем. При Т = 0 прекращается только тепловое движение. Другие (нетепловые) формы движения будут наблюдаться и при абсолютном нуле.
4.Основные уравнения молекулярно-кинетической теории идеального газа для давления
